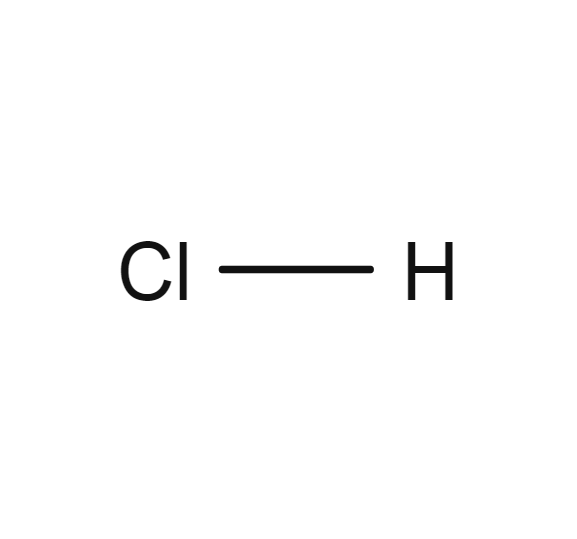
Chlorure d'hydrogène
- HCl
- Numéro CAS 7647-01-0
- UN1050 (gaz)
Cliquez et faites tourner la molécule 3D
Volumes Gaz / Liquide
Calculer le volume ou la masse d'une quantité de gaz ou de liquide
Phase Liquide
Au point d'ébullition à 1,013 bar
Phase Gazeuse
Dans les conditions standard (1,013 bar, 15°C)
Propriétés physiques
Diagramme de phase moléculaire montrant les phases de transition entre le solide, le liquide et le gaz en fonction de la température et de la pression
-
- Masse molaire 36.461 g/mol
- Teneur dans l'air sec /
-
Point critique
- Température 51.50 °C
- Pression 83,1 bar
- Masse volumique 450.14 kg/m³
-
Point triple
- Température -114.18 °C
- Pression 1,3522E-1 bar
Pression 1.013 bar
| Chaleur latente de fusion (au point de fusion) | 54,853 kJ/kg |
| Point de fusion | - 114,18 °C |
Pression 1.013 bar
| Point d'ébullition | - 85 °C |
| Chaleur latente de vaporisation (au point d'ébullition) | 448,87 kJ/kg |
| Masse volumique du liquide (au point d'ébullition) | 1192,98 kg/m3 |
| Densité | 1,27 |
| Conductivité thermique | 13,158 mW/(m.K) |
| Pression de vapeur saturante | 25,6287 bar |
| Viscosité | 1,3405E-4 Po |
| Masse volumique (au point d'ébullition) | 2,4329 kg/m3 |
| Masse volumique | 1,6397 kg/m3 |
| Equivalent gaz/(liquide au point d'ébullition) | 764,73 vol/vol |
| Densité | 1,27 |
| Conductivité thermique | 13,924 mW/(m.K) |
| Pression de vapeur saturante | 37,3556 bar |
| Viscosité | 1,4164E-4 Po |
| Masse volumique | 1,5524 kg/m3 |
| Equivalent gaz/(liquide au point d'ébullition) | 764,73 vol/vol |
| Densité | 1,27 |
| Conductivité thermique | 14,43 mW/(m.K) |
| Pression de vapeur saturante | 47,2216 bar |
| Viscosité | 1,4666E-4 Po |
| Masse volumique | 1,4993 kg/m3 |
Candidatures
Des exemples d'utilisations de la molécule dans l'industrie et la santé

Chimie
L'industrie chimique utilise le chlorure d'hydrogène pour produire une grande variété de composés organiques chlorés. Les métaux chlorés (par ex. les chlorures d'aluminium ou de silicium) sont produits à partir du chlorure d'hydrogène.

Composants électroniques
Dans la fabrication des semi-conducteurs, le chlorure d'hydrogène est utilisé pour la gravure d'oxyde natif, le nettoyage des réacteurs de dépôt chimique en phase vapeur (CVD) ou comme absorbeur d'humidité.

Laboratoires et Centre de Recherche
Le chlorure d'hydrogène est utilisé dans les mélanges gazeux d'étalonnage pour le contrôle des rejets gazeux.

Fabrication métallique
Les procédés d'hydrométallurgie utilisent le chlorure d'hydrogène afin d'améliorer le coefficient de séparation des minerais. Il peut également être utilisé dans les procédés de galvanisation à chaud.

Autre
Mélangé au xénon dans les lasers à excimère, le chlorure d'hydrogène peut produire des longueurs d'ondes qui varient selon les conditions d'utilisation.
Sécurité & Compatibilité
GHS04
Gaz sous pression
GHS05
Corrosif
GHS06
Toxique ou mortel
Seuil de toxicité
| VLI-15min UE (à Patm et 293.15 K) | 15 mg/m3 ou 10 ppm |
| VLI-8h UE (à Patm et 293.15 K) | 8 mg/m3 ou 5 ppm |
| PEL USA OSHA (vol) | 5 [ceiling] ppm |
| VLEP CT France (à Patm et 293.15 K) | 7,5 mg/m3 ou 5 ppm |
Odeur
Acre et suffocante
Métaux
| Aluminium | Non recommandé |
| Laiton | Non recommandé |
| Alliage de Nickel | Satisfaisant |
| Cuivre | Pas de données |
| Aciers ferritiques | Satisfaisant |
| Aciers inoxydables | Satisfaisant |
| Zinc | Pas de données |
| Titane | Pas de données |
Plastiques
| Polytétrafluoroéthylène | Satisfaisant |
| Polychlorotrifluoroéthylène | Satisfaisant |
| Polyfluorure de vinylidène | Satisfaisant |
| Polychlorure de vinyle | Satisfaisant |
| Ethylène tétrafluoroéthylène | Pas de données |
| Polycarbonate | Pas de données |
| Polyamide |
perte de masse importante
Non recommandé
|
| Polypropylène | Satisfaisant |
Elastomères
| Caoutchouc (isobutène- isoprène) butyl |
perte de masse importante
Non recommandé
|
| Caoutchouc nitrile butadiène |
perte de masse importante
Non recommandé
|
| Chloroprène |
perte de masse importante
Non recommandé
|
| Chlorofluorocarbones | Pas de données |
| Silicone |
Perte de masse importante
Non recommandé
|
| Perfluoroélastomères | Satisfaisant |
| Fluoroélastomères | Satisfaisant |
| Néoprène | Pas de données |
| Polyuréthane |
Perte de masse importante
Non recommandé
|
| Ethylène-Propylène | Satisfaisant |
Lubrifiants
| Huile de lubrification à base d'hydrocarbures |
Contamination du matériau
Non recommandé
|
| Huile de lubrification à base de fluorocarbures |
Contamination du matériau
Non recommandé
|
Compatibilité avec les matériaux
En savoir plus
En savoir plus
Joseph Priestley obtint du chlorure d’hydrogène pur en 1772 et, en 1818, Humphry Davy démontra qu'il est composé d’hydrogène et de chlore.